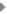सुशील जोशी
आवर्त्त सारणी न सिर्फ तत्वों को सिलसिलेवार जमाने में मदद करती है बल्कि इसकी वजह से कई तत्वों के बोर में खोज से पहले की भविष्यवाणियां करना संभव हो पाया।
अगर इसे पढ़ने का तरीका समझ लिया जाए तो रसायन विज्ञान की कई गुत्थियां काफी सरल हो जाती हैं।
आवर्त्त सारणी का विकास रसायन शास्त्र की सबसे महत्वपूर्ण घटनाओं में से एक है। आवर्त्त सारणी ने रसायन शास्त्र का अध्ययन करने वालों को एक ऐसा औजार दिया है जिसकी मदद से वे ढेरों जानकारियों को करीने से रख सकते हैं, और फिर उन्हें आसानी से प्राप्त भी कर सकते हैं। सबसे बड़ी बात तो यह रही कि इस ‘करीने’ की बदौलत हम तत्वों के संबंध में भविष्यवाणियां करने में भी सफल रहे। संक्षेप में कहा जाए तो यह सारणी रसायनशास्त्रियों के लिए एक बड़ी सहूलियत है।
परन्तु क्या रसायन शास्त्र के छात्र व अध्यापक इस सारणी से प्राप्त सुविधा से लाभ उठा पाते हैं या उनके लिए यह ‘कोर्स’ का एक अध्याय मात्र है जिसे याद किया जाना है? क्या वे इसे एक सुविधा के रूप में देखते हैं या एक बोझ के रूप में?
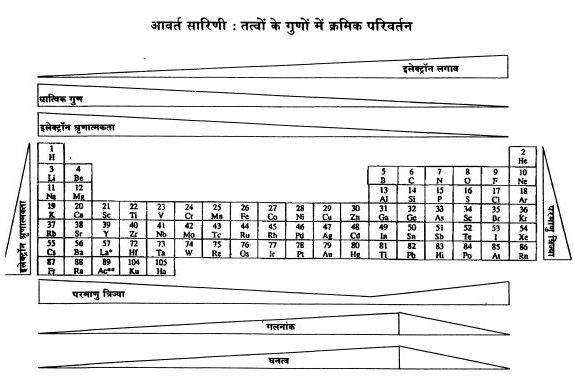
आवर्त्त सारणी से हमारा तात्पर्य आधुनिक आवर्त्त सारणी से है जो निम्नलिखित सिद्धांत पर आधारित है: ‘’तत्वों के गुण उनकी परमाणु संख्या की आवर्त्त अभिव्यक्ति हैं।‘’ अर्थात अगर परमाणु संख्या के क्रम में आगे बढ़ते जाएं तो तत्वों के गुण एक विशेष क्रम में दोहराए जाते हैं। यहां मैं यह मानकर चल रहा हूं कि पाठक आवर्त्त सारणी से परिचित हैं। आवर्त्त सारणी के कुछ चित्र इस लेख के साथ दिए गए हैं। इस सारणी में खड़ी पंक्तियां ‘समूह’ कहलाती हैं और आड़ी पंक्तियां ‘आवर्त्त’ कहलाती हैं।
आवर्त्त
जैसा कि आप जानते हैं इस सारणी में कुल सात आवर्त्त हैं। प्रत्येक आवर्त्त में तत्वों की संख्या अलग-अलग है। पहले आवर्त्त में 2 तत्व हैं, दूसरे व तीसरे आवर्त्त में 8-8 तत्व हैं, चौथे व पांचवें आवर्त्त में 18-18 तत्व हैं, छठे आवर्त्त में 32 और सातवें आवर्त्त में 23 ततव हैं। इससे साफ ज़ाहिर है कि तत्वों के गुणों में आवर्त्तता तो है मगर उसका काई निश्चित अंतराल नहीं है। इसका क्या कारण हो सकता है?
आप संभवत: जानते ही होंगे कि किसी भी तत्व के बुनियादी रासायनिक गुण मूलत: उसकी इलेक्ट्रॉन जमावट (Configuration) पर निर्भर होते हैं। इसमें भी सबसे अहम भूमिका बाह्यतम इलेक्ट्रॉन व्यवस्था समान है तो उनके रासायनिक गुणों में भी समानता होगी। अब किसी आवर्त्त की लम्बाई इस बात पर निर्भर है कि कितने तत्वों के बाद एक मर्तबा फिर वही बाह्यतम इलेक्ट्रॉन व्यवस्था दोहराई जाती है।
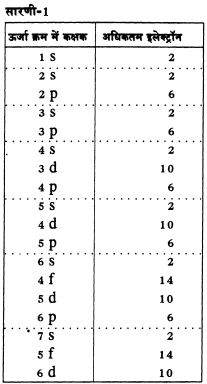
दरअसल प्रत्येक आवर्त्त में मौजूद तत्वों की संख्या हमें बता देती है कि उस आवर्त्त में बाएं से दाएं चलते हुए इलेक्ट्रॉन व्यवस्था में क्या परिवर्तन हो रहे हैं। आप शायद जानते होंगे कि परमाणु में इलेक्ट्रॉनों की जमावट अलग-अलग कक्षकों में होती है। प्रत्येक कक्षक की ऊर्जा व उसमें पाए जा सकने वाले इलेक्ट्रॉनों की अधिकतम संख्या तयशुदा होती है। सारणी-1 एंव 2 को ध्यान से देखिए। इनमें विभिन्न आवर्त्त में तत्वों की संख्या और उनके परमाणुओं से भरे जा रहे कक्षकों से संबंधित जानकारी दी गई है। क्या आप अब समझ सकते हैं कि क्यों अलग-अलग आवर्त्त लम्बाई के हैं।
समूह
आवर्त्तों की पुनरावृत्ति ही समूह बनाती है। यानी किसी भी तत्व से शुरू करें, एक आवर्त्त पूरा होने के बाद जो तत्व आएगा वह पहले वाले तत्व के समान होगा। इस प्राकार से एक ही समूह के तत्वों में बुनियादी समानताएं होती हैं। व्यावहारिक दृष्टि से दरअसल समूह ही ज़्यादा उपयोगी हैं। आवर्त्त सारणी में कुल 18 समूह हैं। इन्हें दर्शाने की प्राय: दो प्रथाएं प्रचलित हैं।
 सरणी -1 प्रत्येक कक्षक की ऊर्जा व उसमें पाए जा सकने वाले इलेक्ट्रॉनों की संख्या तयशुदा होती है। इस सारणी में ऊपर से नीचे की ओर बढ़ती ऊर्जा के क्रम में कक्षकों को जमाया गया है और प्रत्येक कक्षक में पाए जा सकने वाले इलेक्ट्रॉनों की अधिकतम संख्या दर्शाई गई है।
सरणी -1 प्रत्येक कक्षक की ऊर्जा व उसमें पाए जा सकने वाले इलेक्ट्रॉनों की संख्या तयशुदा होती है। इस सारणी में ऊपर से नीचे की ओर बढ़ती ऊर्जा के क्रम में कक्षकों को जमाया गया है और प्रत्येक कक्षक में पाए जा सकने वाले इलेक्ट्रॉनों की अधिकतम संख्या दर्शाई गई है।
सारणी-2 विभिन्न आवर्त्तों में तत्वों की संख्या और उनके परमाणुओं से भरे जा रहे कक्षक।
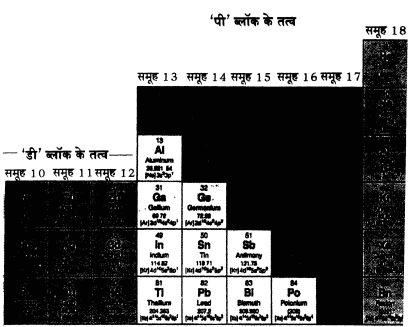
एक प्रथा है जिसमें कुल आठ समूह हैं – I से VIII इन समूहों को A व B उपसमूहों में गांटा गया है तथा VIII B उपसमूह में तीन उप-समूह हैं। यह विभाजन वैसे तो काफी अकारण है। समलन समूह VIII A में तो अक्रिय गैसें हैं और VIII B में लौह, तांबा, निकल जैसी संक्रमण धातुएं (Transition Metal) हैं। बाद में समूह को शून्य समूह भी कहा गया।
आवर्त्त सारण की I से VIII समूह वाली इस व्यवस्था से काफी परेशानियां हो रही थीं, क्योंकि एक ओर पारम्परिक रूप से उत्तरी अमेरिका व रूस के वैज्ञानिक मुख्य समूह के तत्वों A को उपसमूहों में रखते थे और संक्रमण तत्वों (Transition Elements) को B उपसमूहों में। जबकि दूसरी ओर यूरोप के वैज्ञानिक बहुधा बाई ओर के सात समूहों को A तथा दाई ओर के (अक्रिय गैस समूहों को छोड़कर) सात समूहों को B कहते थे। इस वजह से कई भ्रम उत्पन्न हो जाते थे। अन्तत: ‘शुद्ध व प्रयुक्त रसायन संबंधी अंतर्राष्ट्रीय संघ’ (IUPAC) ने फैसला किया कि समूहों को बाएं से दाएं क्रमश: 1 से 18 कहा जाएगा। यही दूसरी प्रथा है। एक ही समूह के तत्वों में समानता होती है। यह बात आप सारणी से देख सकते हैं।
आवर्त्त सारणी में समूहों के ततवो के गुणों में क्रमिक परविर्तनों से तो आप परिरचित हैं ही।
ब्लॉक्स
ऊपर हमने देखा कि तत्वों के परमाणुओं के निर्माण में क्रमश: इलेक्ट्रॉन जुड़ते जाते हैं। ऊर्जा क्रम के मुताबिक ये इलेक्ट्रॉन विभिन्न कक्षकों में भरे जाते हैं। तत्वों के वर्गीकरण का एक आधार यह भी हो सकता है कि किसी तत्व या तत्वों के समुह में कौन-सा कक्षक भरने की प्रक्रिया चल रही है। ऐसा करने पर तत्वों के मूलत: चार समूह बनते है। ये समूह ब्लॉक्स कहलाते हैं। ये ब्लॉक्स हैं- s ब्लॉक, p ब्लॉक, d ब्लॉक, और f ब्लॉक।
इस प्रकार के विश्लेषण से एक व्यावहारिक लाभ यह मिलता है कि हम तत्वों का इलेक्ट्रॉन विन्यास ज्ञात कर सकते हैं। एक उदाहरण से बात स्पष्ट हो जाएगी।
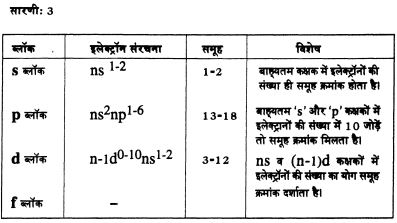 मसलन समूह 14 के दूसरे आवर्त्त के तत्व की इलेक्ट्रॉन संरचना ज्ञात करते हैं। सबसे पहली बात तो यह है कि समूह क्रमांक 13 से ज़्यादा है। सारणी-3 देखने पर पता चलता है कि यह p ब्लॉक का तत्व है। उसी सारणी से यह भी जानकारी मिलती है कि इसके समूह क्रमांक में से 10 घटाने पर हमें बाह्यतम कक्षक में इलेक्ट्रॉनों की संख्या प्राप्त हो जाएगी।
मसलन समूह 14 के दूसरे आवर्त्त के तत्व की इलेक्ट्रॉन संरचना ज्ञात करते हैं। सबसे पहली बात तो यह है कि समूह क्रमांक 13 से ज़्यादा है। सारणी-3 देखने पर पता चलता है कि यह p ब्लॉक का तत्व है। उसी सारणी से यह भी जानकारी मिलती है कि इसके समूह क्रमांक में से 10 घटाने पर हमें बाह्यतम कक्षक में इलेक्ट्रॉनों की संख्या प्राप्त हो जाएगी।
यह हुई 14-10 = 4 इन 4 में से दो इलेक्ट्रॉन तो गए उपकक्षक में और शेष दो गए उपकक्षक में।
यानी इसकी लेक्ट्रॉनिक संरचना हुई : यह इसकी बाह्यतम इलेक्ट्रॉन संरचना है। आमतौर पर रासायनिक दृष्टि से यह जानकारी काफी महत्वपूर्ण होती है।
अब कुछ अभ्यास आपके लिए। इन्हें हल करने के लिए अपको तीनों सारणियों को गौर से देखना होगा। (ध्यान रखें ये अभ्यास करने के लिए आवर्त्त सारणी न देखें।)
- समूह 17 के तीसरे तत्व की बाह्यतम इलेक्ट्रॉन संरचना पात कीजिए।
- यदि किसी तत्व की इलेक्ट्रॉन संरचना है, तो इस तत्व का आवर्त्त सारणी में स्थान पता कीजिए:
यहां का अर्थ है कि इस तत्व की अन्दरूनी इलेक्ट्रॉन संरचना आर्गन जैसी है।
- एक तत्व की इलेक्ट्रॉन संरचना है। पता लगाइए कि यह तत्व किस समूह व किस आवर्त्त में होगा।
- समूह 1, आवर्त्त 3 के तत्व की इलेक्ट्रॉन संरचना पता कीजिए।



गुणों में क्रमिक परिवर्तन
यदि क्रमश: कक्षकों के भरने की बात को ध्यान में रखा जाए, तो तत्वों के भौतिक व रासायनिक गुणों में होने वाले क्रमिक परिवर्तन को समझना संभव हो जाता है। यहां हम एक उदाहरण से इसे समझने की कोशिश करेंगे।
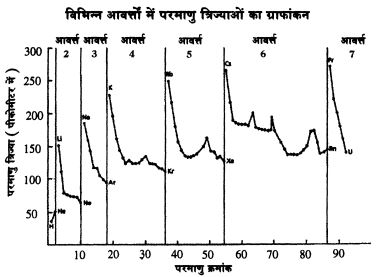 परमाणुओं के अर्धव्यास (त्रिज्या) को ही लें। परमाणु संख्या और परमाणु त्रिज्या का ग्राफ देखिए। आप देखेंगे कि प्रत्येक आवर्त्त के पहले तत्व की त्रिज्या सबसे अधिक होती है तथा इसके बाद परमाणु संख्या बढ़ने के साथ-साथ केन्द्रक पर धनावेश बढ़ता जाता है ओर यह बढ़ा हुआ धनावेश इलेक्ट्रॉनों को ज़्यादा ताकत से अपनी ओर खींचता है। लिहाज़ा इलेक्ट्रॉन केन्द्रक के ज़्यादा करीब रहते हैं।\
परमाणुओं के अर्धव्यास (त्रिज्या) को ही लें। परमाणु संख्या और परमाणु त्रिज्या का ग्राफ देखिए। आप देखेंगे कि प्रत्येक आवर्त्त के पहले तत्व की त्रिज्या सबसे अधिक होती है तथा इसके बाद परमाणु संख्या बढ़ने के साथ-साथ केन्द्रक पर धनावेश बढ़ता जाता है ओर यह बढ़ा हुआ धनावेश इलेक्ट्रॉनों को ज़्यादा ताकत से अपनी ओर खींचता है। लिहाज़ा इलेक्ट्रॉन केन्द्रक के ज़्यादा करीब रहते हैं।\
परन्तु ग्राफ में एक असामान्यता पर ध्यान दीजिए। आवर्त्त 1, 2 व 3 में तो परमाणु त्रिज्या लगातार घटती जा रही है मगर आवर्त्त 4 व 5 में एक बिन्दु पर आकर त्रिज्या एक बार फिर बढ़ने लगती है। इसका कारण यह है कि इन दो आवर्त्तो में कक्षक भरे जा रहे हैं। ये कक्षक की तुलना में केनद्रक के ज़्यादा ‘समीप’ होते हैं। अत: इनमें मौजूद इलेक्ट्रॉन कुद हद तक बाहरी इलेक्ट्रॉन पर केन्द्रक का प्रभाव कम कर देते हैं। तो ये इलेक्ट्रॉन उतनी ताकत से आकर्षित नहीं होते और थोड़े ‘पसर’ जाते हैं। तत्वों के गुणों में परिवर्तन के संबंध में कुछ जानकारियां साथ वाले पेज पर दी गई हैं।
सुशील जोशी: विज्ञान लेखन में सक्रिय। होशंगाबाद विज्ञान शिक्षण कार्यक्रम से संबद्ध।